演習問題3補充
RERとゴルジ体に連れて行かれる翻訳中のタンパク質たちについて。
各細胞小器官にあるタンパク質は、(((アミノ酸)))配列の情報に基づいて運ばれる。分泌タンパク質、膜タンパク質、リソソーム酵素は(((N)))末端側に(((疎水)))性アミノ酸が多く、これを(((シグナルペプチド)))と呼ぶ。分泌タンパク質は最初は細胞質の(((遊離)))リボソームで翻訳されているがmRNAからポリペプチドへの翻訳がある程度進むとシグナルペプチドを認識する粒子(signal recognition particle:SRP)が結合し、翻訳を(((一時停止)))させ、(((RER)))にリボソーム-mRNA複合体を運ぶ。
SRPは、タンパク質とRNAの複合体である。SRPはRER上に存在するSRP受容体にSRP-リボソーム-ポリペプチド複合体を運び、RER膜を貫通して存在するトランスコロンにリボソーム-ポリペプチド複合体を結合させる。結合するとSRPは離れ、RERで翻訳が再開続行される。
RERにおけるペプチド合成と修飾
シグナルペプチドはRER膜に存在する(((シグナルペプチターゼ)))の働きで分解される。合成されたポリペプチド鎖は、小胞体(((シャペロン)))の助けを借りて正しい立体構造をとる。また小胞体(((内腔)))では糖鎖が付与される。糖鎖にはアスパラギン残基に結合するタイプ(N結合型糖鎖)、セリンやスレオニンの水酸基に結合するタイプ(O型結合型糖鎖)がある。RER内で翻訳が終了し、糖鎖を付与されたタンパク質は(((ゴルジ装置)))に送られてさらに(((糖鎖)))の付与や切断など一連の化学反応を受け(プロセッシング)完成系になる。(翻訳後修飾)
より正確にはN結合型糖鎖はRER内で、O結合型糖鎖はゴルジ装置内でそれぞれ付加される。RERからゴルジ装置への輸送は(((小胞輸送)))(vesicular transport)の形式でおこなわれる。この場合、小胞体の膜の一部が目的タンパク質を含んで(カーゴcargo)、くびれ出し(出芽bubbing)、ちぎれて輸送小胞となり輸送される。輸送小胞は(((ゴルジ装置)))と結合し、膜が融合することで目的タンパク質をゴルジ装置内に送り届ける。輸送小胞上にはv-SNAREという膜タンパク質があり、ゴルジ装置側にはt-SNAREという膜タンパク質がある。2つのSNAREが正しく結合したときのみ膜融合が起こるようになっている。
ゴルジ装置内で完成した分泌タンパク質は、分泌顆粒または分泌小胞となって細胞膜に送られ、今度は細胞膜表面と膜融合することで細胞外に送り出される。この過程を(((エキソサイトーシス(exocytosis))))や(((開口分泌)))という。
なおゴルジ装置においてポリペプチドの糖鎖(((マンノース)))が(((リン酸)))化を受けると、そのポリペプチドは、(((加水分解)))酵素である(((リソソーム)))として細胞質に(((小胞)))体のまま留まる。一方、膜へ行く酵素で、(((疎水)))性アミノ酸を有する領域(((膜貫通ドメイン)))を持つものは、膜タンパクとして(((留まり)))、そうでないものは(((エクソサイトーシス)))で細胞外に分泌される。
演習問題3
細胞内での物質輸送
細胞のタンパク質分泌に関する次の文を読み答えよ。
B細胞が最終的に分化すると、盛んに免疫グロブリン(以下Igとする)を分泌する(((形質orプラズマ)))細胞となる。多発性骨髄腫はこの(((形質)))細胞が腫瘍化した疾患である。したがって多発性骨髄腫の細胞はタンパク質の分泌機構を研究する上でよい材料となる。そこで次のような実験が行われた。
[実験]
(1)多発性骨髄腫細胞からIg軽鎖のmRNAを分離精製し遊離リボソームを用いてin vitroで翻訳した。
(2)多発性骨髄腫細胞から分泌されたIg軽鎖を分離精製した。
(1),(2)で得られたIg軽鎖をゲル電気泳動すると、下図に示すようにバンドの位置が若干ずれ(1)で得られたIg軽鎖の分子量の方が若干大きいことが判明した。(図の下方が泳動の方向を示す)。それぞれのアミノ酸配列を比較すると(1)で得られたIg軽鎖には(2)で得られたIg軽鎖にはないアミノ酸がN末端に約20個余計に存在していた。

(3)実験(1)で分離精製したIg軽鎖のmRNAを粗面小胞体を用いてin vitroで翻訳した。
(4)実験(3)の開始後、しばらくしてからタンパク質分解酵素を反応系に加えたが、結果は(3)と異ならなかった。
in vitroの意味は?(((試験管内での実験を指す)))
なぜ多発性骨髄腫細胞はタンパク質の分泌機構を研究する上で良い材料になるのか。
(((この形質細胞は、粗面小胞体とゴルジ体を通ってきて発現するとともに1種類の(ガン化した)免疫グロブリンだけを分泌するので)))
問2実験(3)の電気泳動の結果はどうなるか。バンドの位置を図で示せ。
((((2)と同じ位置)))
理由(((実験3ではmRNAをRERで翻訳しているので、シグナルペプチドは切られるので)))
問3実験(4)で実験(3)と同じ結果が得られたのは、なぜか?
(((Ig軽鎖は、RERで合成されているので反応系にタンパク質分解酵素を加えても分解されない。)))
(1)の実験はIg軽鎖のmRNA+遊離リボゾームなのでシグナルペプチドは残っている。
(2)の実験はすでにRERを通ってきたIg軽鎖なので、シグナルペプチドは切られている。
(3)の実験はIg軽鎖のmRNA+RERで翻訳されているので、シグナルペプチドは切られている。
演習問題2-2
ある種の腫瘍細胞は細胞内にcAMPが蓄積すると死ぬという特異な性質を持っており、ノルアドレナリン(ノルエピネフリン)を含有した培地では死ぬ。この腫瘍細胞を形態培養しているとノルアドレナリン含有培地でも増殖できる変異株が得られることがある。この変異株には、どのようなタンパク質の変異があると考えられるか。考えられる可能性を挙げよ。
(((理論的にノルアドレナリン受容体、Gタンパク質、アデニル酸シクラーゼの変異が考えられる。)))
(((cAMPが蓄積すると死ぬ→cAMPが生成しなくなると生き残るということ→cAMP生成時点より前の過程での不具合が原因)))
グルカゴン・アドレナリン・ノルアドレナリン+受容体
↓
αサブユニット+GDP
↓
αサブユニット+GTP
↓
アデニル酸シクラーゼが活性化
↓
ATPがcAMPに
↓
cAMPがプロテインキナーゼAを活性化
↓
PKAがグリコーゲン・ホスホリラーゼ・キナーゼをリン酸化・活性化
↓
グリコーゲン・ホスホリラーゼが活性化
↓
グリコーゲンに作用して分解促進してグルコースへ
↓
血糖値の増大
シグナル伝達
Gタンパク連結-アデニル酸シクラーゼ-活性化型
受容体にホルモンが結合すると受容体の(((立体構造)))が変化して、同じ膜上の近くにある3つのサブユニットα,β,γからなる3量体型(((GTP結合タンパク質)))に作用し、αサブユニットに結合していた(((GDP)))が外れる。GDPが外れたαサブユニットには、かわりに(((GTP)))が結合し、αサブユニットが(((活性化)))される。αサブユニットは、β,γサブユニットと離れて膜上を移動し、(((アデニル酸シクラーゼ)))と結合、(((アデニル酸シクラーゼ)))を活性化する。活性化されたアデニル酸シクラーゼは、細胞内に沢山ある(((ATP)))を(((cAMP)))という別のヌクレオチドに変換する。cAMPは(((プロテインキナーゼA)))に結合して、プロテインキナーゼA-cAMP複合体[PKA]を形成し活性化する。このプロテインキナーゼA-cAMP複合体は、活性のない(((グリコーゲン・ホスホリラーゼ・キナーゼ)))酵素をリン酸化・活性化する。リン酸化・活性化したグリコーゲン・ホスホリラーゼ・キナーゼ酵素は、活性のない(((グリコーゲン・ホスホリラーゼ)))をリン酸化・活性化する。リン酸化・活性化したグリコーゲン・ホスホリラーゼは、(((グリコーゲン)))に作用し分解してグルコースにする。
結局のところ、グルカゴン、アドレナリン、ノルアドレナリンなどのホルモンは、血糖値を上げるために膜上のレセプターに結合してGタンパク連結のシグナル伝達をおこなって、最終的にグリコーゲンに作用してグルコースに戻して血糖値を上げている。これらグルカゴン、アドレナリン、ノルアドレナリンなどのホルモンは最初に細胞に情報を与えるので(((ファーストメッセンジャー)))と呼ばれる。またcAMPのようにシグナル伝達でカギとなる低分子化合物を(((セカンドメッセンジャー)))と呼ぶ。
キナーゼとは?
(((ヒドロキシ基)))を(((リン酸化)))する酵素のことである。アミノ酸のうち、ヒドロキシ基のあるものは、3つありそれぞれ、(((Ser:セリン)))、(((Thr:スレオニン)))、(((Tyr:チロシン)))である。キナーゼが(((立体構造)))を大きく変えることでタンパク質を修飾している。
演習問題2
シグナル伝達物質とその作用機構
〓細胞には種々の様式でタンパク質が存在し、その中には細胞膜に存在するものも多い。これに関して以下の実験を行った。
[実験1]
2つの生理活性物質(ホルモンまたはサイトカイン)A,Bがある。
(1)まずA,Bを放射性同位元素で標識した。
(2)Aを培養ヒト繊維芽細胞に加えて放射能を測定した。放射線を測定することでホルモンが細胞にどれほど結合したかを測定できる。
(3)また細胞培養液にトリプシンを加えた。トリプシン処理によって細胞膜の外側に存在するポリペプチド鎖が分解されるが、細胞膜の内側に存在するポリペプチド鎖は影響を受けない。トリプシン処理細胞にAを加えて放射能を測定した。
(4)Bについても(2),(3)と同様の実験を行った。
(2)~(4)の結果をまとめて表1に示す。

問1下線部の理由を1行で述べよ。
(((トリプシンは細胞膜を通過できないから)))
補充問
生理活性物質のステロイドは(((疎水)))性(((低)))分子であり、ペプチドは(((高)))分子なので、ステロイドは膜を(((通り)))、ペプチドは膜を(((通らない)))。疎水性低分子で膜を通るものは、(((ステロイド)))ホルモン、(((甲状腺)))ホルモン、(((ビタミンA)))、(((ビタミンD)))がある。低分子でも親水性である(((カテコールアミン)))、(((アセチルコリン)))は膜を通らない。ポリペプチドであるサイトカインや増殖因子は、ポリペプチド=(((高分子)))であるため膜は通れない。
問2生理活性物質A,Bは一方がペプチドで他方がステロイドであることが判明している。ペプチドはどちらか。理由を付けて答えよ。
(((ペプチドはB。トリプシン処理で細胞での結合が有意に減少しており、これは細胞膜受容体が分解されたためと考えられる。)))
※ステロイドは、疎水性低分子なので膜を通ることができる。だからAのようにトリプシン処理で細胞膜受容体がなくなっても、ステロイドは自由に膜を通過できるので放射能値は変わっていない。
[実験2]
赤血球を溶血させると細胞内容が流出する。この後、適当な条件を与えると残存した細胞膜が再び閉じる。このような操作で再構成された膜をゴーストという。ゴーストは正常な向きで閉じることもあるが、内側と外側とを反対にして閉じることもある。いま赤血球に存在する酵素P,Qの活性を種々の条件で測定して表2の結果を得た。

問3酵素Pは細胞でどこに存在するか。
(((細胞質に存在する)))
※酵素Pは正常・裏返しに閉じたゴーストの両方で酵素活性が失われているので、これはすでに溶血した時点でどこかへ飛んでいってしまった細胞室内にある酵素と考えられる。
問4酵素Qは細胞でどのように存在するか。存在部位と存在様式とを会わせて2行以内で説明せよ。
(((QはX構造を持つ糖鎖に結合して細胞膜の外側に局在する。)))
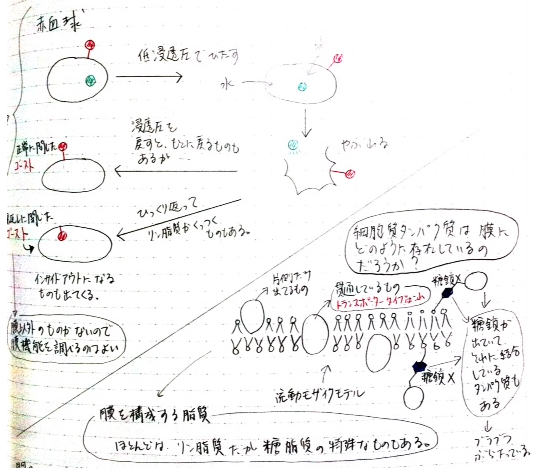
酵素Qは正常に閉じたゴーストでは残っており、裏返しゴーストでは0だから、細胞表面にあったレセプターであるということが分かる。また糖鎖X分解酵素で処理するとほとんどなくなっていることから、X構造を持つ糖鎖に結合している酵素であると考えられる。
演習問題1
1.細胞膜を回する物質輸送
細胞膜の種々の物質の濃度は、細胞を取りまく外液とは異なるように維持されている。一般に細胞内液は細胞外液に比べてKイオンの濃度は高くNaイオンの濃度は低い。このような細胞のイオン濃度の調整の仕組みを調べる目的で以下の実験を行った。
実験1
取り出したヒトの赤血球を細胞外液と同じようなイオン組成の溶液に浮遊させ、①4℃に数日間放置したところ、赤血球内のKイオンの濃度は低下し、Naイオンの濃度は増加し、細胞外液の値に近づいた。そこで②温度を37℃に上げたところ、数時間で赤血球内のKイオン濃度が増加し、Naイオンの濃度が減少した。しかし③37℃のまま数時間が経過すると、赤血球内のKイオン濃度の減少と、Naイオン濃度の増加が見られた。
(参考)図に温度を37℃に上げてからの赤血球内Kイオン濃度の変化を示す。

実験2
実験1に引き続き④赤血球の浮遊液にブドウ糖を加えたところ、赤血球内のKイオンの増加とNaイオン濃度の減少が起こり、それぞれの取り出したときの赤血球の値に近づいた。⑤ブドウ糖のかわりにATPを加えたのでは効果はなかった。
問1以下について理由を簡潔に述べよ。
①4℃に数日間放置したところ、赤血球内のKイオンの濃度は低下し、Naイオンの濃度は増加し、細胞外液の値に近づいた。
(((4℃は、Na,K-ATPaseの至適温度よりはるかに低温であり、この酵素の活性が低下したから)))
②温度を37℃に上げたところ、数時間で赤血球内のKイオン濃度が増加し、Naイオンの濃度が減少した。
(((37℃はNa,ATPaseの至適温度であり、この酵素の活性が復活したから)))
③37℃のまま数時間が経過すると、赤血球内のKイオン濃度の減少と、Naイオン濃度の増加が見られた。
(((ブドウ糖が供給されなかったのでATPが枯渇したから。)))
④赤血球の浮遊液にブドウ糖を加えたところ、赤血球内のKイオンの増加とNaイオン濃度の減少が起こり、それぞれの取り出したときの赤血球の値に近づいた。
(((ブドウ糖が赤血球に取り込まれ、ATP産生に利用されたから。)))
⑤ブドウ糖のかわりにATPを加えたのでは効果はなかった。
(((ATPは赤血球に取り込まれないから)))
〓培養肝細胞(以下「細胞」とする)を検体として、培養液中のグルコース濃度[Glc]をいろいろに変えて、細胞へのグルコース取り込み速度をVを測定した。結果を図に示す。この曲線は双曲線であり、Vは[Glc]の関数として
V=Vmax[Glc]÷(Km+[Glc])
と表される。ただし、VmaxとKmとは定数である。
この実験に関して答えよ。
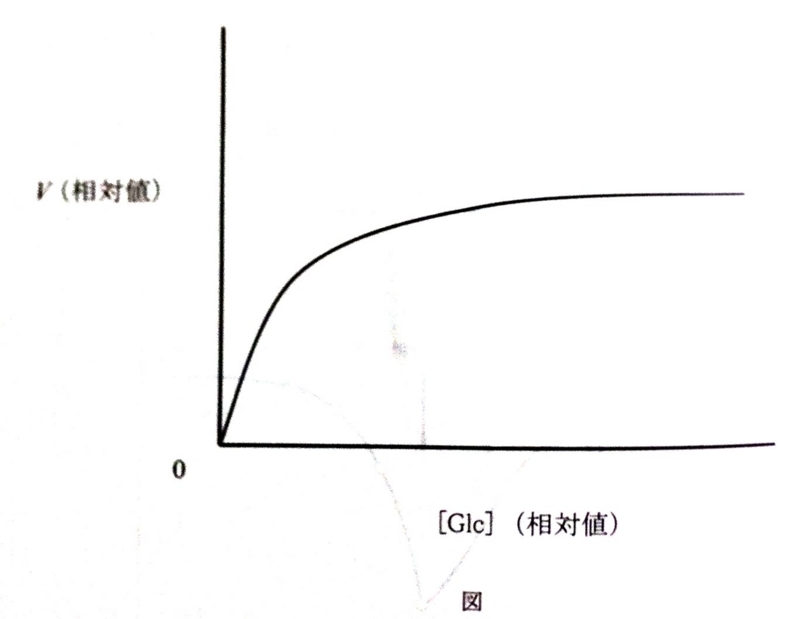
問1細胞へのグルコースの取り込みは単純拡散ではおこらない。
Aその理由をグルコース分子の性質に基づいて30字以内で述べよ。
(((グルコースは親水性が高く細胞膜を通過できないから)))
Bまた単純拡散の場合、グラフはどのようになるはずか。理由を付けて30字以内で述べよ。
(((拡散速度はグルコース濃度差に比例するので直線となる。)))
問2図のグラフを変換して横軸を1/[Glc]、縦軸を1/Vとする。この変換で横軸切片、縦軸切片はそれぞれ何を表すか。
(((横軸切片は-1/Km、縦軸切片は、1/Vmax)))
問3グルコースの取り込み阻害剤を加えて同様の実験を行い、次の結果を得た。この阻害剤はどのような様式でグルコースの取り込みを阻害するか。根拠とともに60字以内で説明せよ。

(((Vmaxは変わらないので、この阻害剤はグルコースと競合してグルコーストランスポーターに結合すると考えられる)))

- 1/Kmが大きくなる→Kmが上昇→阻害剤とグルコースが活性中心を奪い合うので、グルコース取り込み速度は低下するが、Vmaxは一定でありこれはGlc濃度を目一杯大きくしてやると阻害剤の影響はなくなるということを意味する。
問4細胞数はそのままで、あらかじめ細胞にインスリンを作用させてから同様の実験を行った。その結果はどうなるか。図に書き込め。
答えへの考え方は?
→(((インスリンが膜に作用すると標的細胞である肝細胞、筋肉細胞、脂肪細胞に対してGlcの取り込みを促進させて血管内の血糖を下げようとする。これはインスリンが標的細胞の核内のGLUT遺伝子に作用し転写を起こさせることでGLUTを発現させ細胞膜に局在させて、血中のグルコースを取り込ませるというものである)))

演習問題2補充
生理活性物質と受容体
生理活性物質には膜を(((通れない)))ものと(((通れる)))ものがある。生理活性物質の標的細胞は、その生理活性物質に対応する(((受容体)))を持っている細胞のことを指す。膜を通れる生理活性物質の受容体は、膜上にある必要がない。例えば(((低)))分子(((疎水)))性の甲状腺ホルモンの受容体はDNAに結合しており、受容体が(((転写因子)))として標的遺伝子の転写を制御している。また膜を通れない生理活性物質は、膜状にある受容体に結合したのち、シグナルが細胞内にでて、いろいろなレスポンスが現れる。このことを(((シグナル伝達)))と呼ぶ。 たとえばインスリンは標的細胞の膜上にある(((インスリン受容体)))と結合した後、シグナル伝達で(((GLUT)))を発現させグルコースを取り入れ血糖を細胞に取り込ませる。
受容体の種類
シグナル伝達における膜レセプターは、大きく3種類がある。1つはアセチルコリン受容体などの(((イオンチャンネル)))。二つ目は、アドレナリン・グルカゴン受容体である(((Gタンパク連結)))。3つめはインスリン受容体の(((酵素連結=チロシンキナーゼ)))である。